近日,国家药品监督管理局药品审评中心再发布三条新的指导原则,分别为:《儿童用药沟通交流申请及管理工作程序》、《慢性淋巴细胞白血病新药临床研发技术指导原则(征求意见稿)》、《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》
详情如下:

《儿童用药沟通交流申请及管理工作程序》
第一条(背景目的) 根据《药品注册管理办法》(国家市场监督管理总局令第 27 号)以及《药物研发与技术审评沟通交流管理办法》(2020 年第 48 号),加强儿童用药沟通交流管理,提高沟通交流效率,切实推动我国儿童用药创新研发进程,制定本工作程序。
第二条(适用范围) 本工作程序适用于申请人提出的符合以下四种情形之一的针对临床研究计划或临床研究结果的沟通交流会议申请(以下简称申请)。
情形一:已列入《鼓励研发申报儿童药品清单》的品种。情形二:针对主要患病人群为儿童,且已列入国家卫生健康委员会等部门发布的罕见病目录的疾病或国家卫生健康委员会认定的重大传染病而研发的品种。
情形三:专为儿童使用而开发的 1 类创新型或 2 类改良型新药,包括化学药品、预防用生物制品、治疗用生物制品和中药。
情形四:已在境外上市且已获得儿童应用许可,申请在我国获得儿童应用许可的药品,且该药品对满足我国儿科临床治疗需求有重要价值。具体包括:该药品已进口且已在我国获得成人应用许可,申请在我国获得相同适应症的儿童应用许可;该药品已进口且已在我国获得部分年龄段儿童应用许可,申请在我国扩展相同适应症儿童年龄段的应用许可; 该药品已进口且已在我国获得某一/某些适应症儿童应用许可,申请在我国获得其他适应症的儿童应用许可;该药品已进口且已在我国获得某一/某些适应症成人应用许可,申请在我国获得其他适应症的儿童应用许可;该药品未进口,申请在我国获得儿童应用许可(申请可包括相同适应症成人应用许可)。
第三条(提出申请) 申请人按照《药物研发与技术审评沟通交流管理办法》(2020 年第 48 号)提交沟通交流会议申请,在填写申请表时,可参照本文件第二条在“会议目的(简要说明)”中注明所属情形。示例:按照《儿童用药沟通交流申请及管理工作程序》第二条情形一申请按照 I 类会议进行管理。符合本文件第二条情形但申请人未注明所属情形的沟通交流申请,不纳入管理流程调整范畴。
第四条(资料要求) 申请人需填写《申请调整儿童用药沟通交流会议类型的说明》(附件),作为沟通交流会议资料一并提交电子版。
第五条(管理流程) 药品审评中心项目管理人员在收到沟通交流会议申请后,根据“会议目的(简要说明)”注明信息进行会议类型调整,II 类会议申请调整为 I 类会议进行管理,I 类会议申请和III 类会议申请不纳入管理流程调整范围。适应症临床审评团队负责对《申请调整儿童用药沟通交流会议类型的说明》进行审核,确认符合情形要求的继续按照 I 类会议管理;不符合情形要求的调整回 II 类会议管理;符合情形要求但申请资料存在重大缺陷的,调整回II 类会议管理。
第六条(其他要求) 本文件中未规定事宜,按照《药物研发与技术审评沟通交流管理办法》(2020 年第 48 号)执行。
第七条 本工作程序自发布之日起执行。
第八条 附件





《慢性淋巴细胞白血病新药临床研发技术指导原则》(征求意见稿)
一、概述
慢性淋巴细胞白血病(Chronic lymphocytic leukemia,CLL)是一种具有特定免疫表型特征的成熟B淋巴细胞克隆增殖性肿瘤,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征,目前仍为不可治愈的疾病。该疾病主要发生在中老年人群,中位发病年龄超过70周岁[1,2],随着社会老龄化程度加深,慢性淋巴细胞白血病的发病率呈增高趋势。CLL患者的中位生存期可达10年,但不同患者的预后具有高度异质性,其相对隐匿和惰性的疾病特征使得治疗时机非常重要;与此同时,该疾病高发于老年人群,又进一步增加了治疗方案选择的复杂性[3]。在过去的20年里,CLL的治疗选择不断增加,从最初的单纯化疗为主进入免疫化疗时代,近几年更是随着各种低毒的小分子口服靶向药物不断出现,去化疗方案逐渐成为优选方案。选择CLL治疗方案时,患者的基础条件、耐受性和治疗意向会对可实现的治疗目标产生非常大的影响,也给新药研发过程中临床试验的设计和执行带来挑战。针对疾病进展呈现惰性特征,高发于耐受性相对较差、合并症较多的老年人的CLL,如何在疾病管理过程中实现改善患者生活质量与传统抗肿瘤治疗理念之间的平衡,是新药研发中必须关注的问题。本技术指导原则将立足于当前的临床实践,结合近年来新药研发的经验和挑战,就CLL新药临床研究如何在设计和执行过程中充分考虑疾病特征和患者需求提出观点。
小淋巴细胞淋巴瘤(Small lymphocytic leukemia,SLL)与CLL是同一疾病的不同表现,但确诊必须依赖病理组织学及免疫组化检查。除LuganoⅠ期SLL采用局部放疗外,其他治疗指征和治疗选择与CLL相同。因此本技术指导原则除诊断、疗效评价标准等临床上存在差别的内容外,其他内容同样适用于SLL。
本技术指导原则中的观点和建议仅代表药品审评机构现阶段的考虑,部分内容可能随着临床实践的变化不再适用,供药物研发的申请人和研究者参考,不具有强制性的法律约束力。应用本技术指导原则时,还请同时参考国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)和其他国内外已发布的相关技术指导原则。
二、基于疾病特征的临床研究特殊考虑
(一)治疗指征的确定
多数CLL患者在确诊时仅有实验室检查异常而没有临床症状,患者的生活质量不受疾病直接影响,呈现出典型的隐匿和惰性特征。当前的临床共识是:“非活动性”(如无症状或疾病分期级别较低)的CLL患者不需要立刻接受治疗,标准处理方案(standardofcare,SOC)为随访观察,早期干预并不能改善这部分患者的长期生存[2]。原则上,CLL新药临床试验应以具有治疗需求,即存在治疗指征的患者为研究人群,方案中应该明确定义“治疗指征”。境内外临床实践对“治疗指征”的定义基本一致,具体表述上略有不同,在开展国际多中心临床试验时应注意协调。疾病复发并非开始后续治疗的充分条件,在复发人群中开展临床试验也应该确定患者具有“治疗指征”。如果某一创新药希望开展CLL早期干预的临床试验(即纳入无常规“治疗指征”的患者),需要非常谨慎。按照一般的抗肿瘤药研发规律,应至少先在具有“治疗指征”的患者人群中完成概念验证,再考虑将研究人群拓宽至无“治疗指征”的患者,且积极与药审中心沟通交流。需要指出的是,即使通过早期干预推迟了无“治疗指征”患者进入下一阶段治疗的时间(例如延长了无事件生存期),也不代表早期干预对患者整个CLL病程的管理是有利的。
(二)治疗目标的选择
一般而言,肿瘤的治疗过程中,降低治疗强度可能直接影响疾病的治愈率或缓解率,并影响对无进展生存期和/或总生存期的改善。但高强度的治疗也可能带来更多的治疗相关毒性,造成不耐受者早期停药,或者对器官功能带来不可逆的损害影响患者长期生活质量,甚至增加非进展性死亡风险。CLL患者中相当一部分为≥75周岁的高龄患者,患病年龄已经接近整体人群的平均预期寿命,患者从温和的治疗方案中可能获得比年轻患者更有意义的临床获益,治疗毒性则更容易对其生活质量和长期生存造成无法挽回的损失。因此,启动某一新药在CLL人群中的临床试验时,应结合药物的机制和潜在毒性,对目标人群进行预判,例如细胞毒性药物选择年龄<65周岁或治疗目标为通过深度缓解延缓疾病进展的患者,而低毒性可长期维持治疗的靶向药物或治疗方案则可选择身体状态欠佳或以改善预期寿命期间生活质量为治疗目标的老年患者。
(三)治疗人群的分层
确定治疗指征和治疗目标后,需根据患者的一般情况、生物学特征和治疗目标进行分层治疗。具有某些生物学特征(例如del 17p、TP53突变)的患者通常对化疗反应不佳而对新的治疗手段有更大的临床需求。CLL患者多为70周岁以上的老年人,临床实践中影响治疗决策的因素较多,为了提高临床试验筛查受试者的可操作性,应在入组前结合患者的年龄和健康状态评估结果判断患者大致属于哪个治疗分层。虽然年龄不是决定患者身体状态的唯一因素,但年龄增长使个体对治疗的耐受程度呈现下降趋势,且与更多的合并症、器官功能受损、认知障碍存在相关性。各国对“老年”的定义有所不同,但CLL的治疗中一般认为年龄<65周岁[3]代表对高强度治疗具有相对良好的耐受能力,且对深度或持久缓解的治疗需求更大,而≥65周岁的患者需要根据其身体状态来选择治疗方案。如何综合判断患者的身体健康状态,在血液系统恶性肿瘤中仍然存在需要探索的空间,借助合适的老年人健康评估工具是判断患者身体状态的常用手段,老年疾病累计评分法(cumulative illness rating scale for geriatrics,CIRS-G)是CLL临床试验中较为常用的评估工具[1, 5],但是这些已经在西方人群中与死亡、残疾或住院等重要事件之间有良好相关性的工具,在中国人群中多数缺乏科学严谨的验证研究。
(四)其他考虑
针对老年患者易伴有认知障碍的特点,应提供与之年龄特点相称的知情同意书,必要时应该同时提供需监护人签署的知情同意书。
三、剂量探索
抗肿瘤创新药的早期研究(尤其剂量递增阶段)通常会选择相对年轻或体力状况评分较好的患者/健康志愿者进行剂量探索,在以CLL为目标适应症时就可能导致基于早期研究所确定的给药剂量或方案并不适用于所有患者(尤其高龄患者或体能状态差者),年轻患者的耐受性及治疗反应可能与老年患者存在差异。
首先,应根据药物机制选择剂量探索的整体方向和策略,例如细胞毒性药物仍然可以采用抗肿瘤新药传统的以剂量限制毒性为指标确定最大耐受剂量的策略,因为理论上这类药物的疗效随着暴露增加而增加;对于具有与药效相关性良好的生物标志物的靶向药物,可以根据剂量递增过程中的暴露-效应关系分析结果,选择药效学指标进入平台期前的给药剂量作为扩展剂量或II期推荐剂量(RP2D),减少无增效的过度暴露。
其次,根据确定扩展剂量或后期研究剂量的具体方法,并结合前期研究所纳入受试者的整体特征,分析是否需要在高龄患者中进一步开展相对较低剂量方案的探索性研究,以及是否需要根据不同人群的治疗目标调整给药剂量。剂量探索或扩展过程中应充分考虑不同人群的耐受性特征和/或治疗目标,并且在临床研究阶段纳入足够比例的老年患者(关注≥75周岁者的高龄患者)以分析和确定年龄/基础状况对药代动力学、耐受性和药效学的影响。应关注针对药物治疗毒性的剂量调整策略,是采用暂停用药还是降低剂量更有助于取得长期治疗获益。
给药时长的合理性也应该是探索阶段需要重点关注的问题之一。一般而言,细胞毒性药物常采用有限周期的冲击式治疗策略,而近年来研发成功的小分子口服靶向药物常采用长期持续治疗策略。但是,在实现缓解(尤其是完全缓解)后维持原有剂量和频率继续治疗的获益存在争议,尤其是脏器功能较脆弱合并用药较多的高龄患者,临床研究期间应对停药可能性以及停药时机进行探索。
老年患者合并肝肾功能损伤者比例高,骨髓代偿能力相对较弱,存在基础疾病(例如高血压、糖尿病、心肺疾病)并且需要服用其他药物治疗的可能性大,因此应该尽早开展肝肾功能对药代动力学影响、药物相互作用相关研究,更加积极地关注药物对心脏电生理学的影响。在早期研究中,在预判不会带来额外治疗风险的前提下,可以适当放宽对受试者肝肾功能、骨髓功能、心肺功能的限制,使入组的患者更能代表真实世界的CLL患者特征。
四、有效性终点
CLL人群临床试验中与抗肿瘤疗效相关的有效性终点,包括缓解率、时间相关指标和症状终点等,遵循抗肿瘤药物临床试验终点的一般原则和定义[6]。
(一)缓解或进展
临床上通过评价肿瘤负荷的变化和骨髓造血功能的恢复情况判断疾病是否发生缓解或进展,应采用临床实践中广泛应用且有充分循证依据支持的评价标准,具体判断标准不在本技术指导原则中赘述。境内外常用的疗效评价标准存在差异,在开展国际多中心临床试验时应该注意协调[3, 7]。在新靶点药物研发过程中,可能会出现常规的疗效评估标准不适用的情形,应该从早期临床试验起密切观察这些新现象的临床意义,分析新的治疗反应类型对无进展生存时间或生存时间可能产生何种影响。缓解持续时间短于6个月的缓解被认为不具有临床意义[7]。
完全缓解(Complete Remission,CR):当淋巴结、肝脾、外周血检查结果和临床症状提示患者可能CR时,应该实施骨髓穿刺或活检进行确认。如果患者除骨髓造血功能外,其他症状、体征和检查结果(包括骨髓穿刺或活检)都符合CR,并且可确认贫血、血小板降低或中性粒细胞减少与CLL无关,可以被诊断为不完全CR(CRi)。临床试验中,应该对评价为CRi的患者转归进行严密随访,而不是简单将其与CR者合并。临床试验中,应该采用淋巴结、脾脏和/或肝脏的CT检测结果作为疾病缓解的判断依据。
部分缓解(Partial Remission,PR):外周血淋巴细胞绝对值及其相对基线的变化情况通常是判断CLL患者发生缓解或进展的重要指标之一,但是部分靶向治疗药物在治疗初期出现单纯的淋巴细胞升高,继续治疗后淋巴细胞逐渐恢复正常。疗效评价标准针对这种情形进行了修正,单纯的淋巴细胞升高不作为疾病进展的依据,其他指标达到部分缓解标准时被评价为伴淋巴细胞升高的部分缓解(PR-L)。在临床试验中,应该对评价为PR-L的患者转归进行严密随访,这些患者可以在出现其他进展依据前不被评价为疾病进展,但也不能简单地将其与PR患者进行合并,尤其应对“进行性淋巴细胞增多”是患者唯一治疗指征且被判断为PR-L的患者加以关注。在与历史数据进行对照时,不应该将PR-L计入ORR进行比较。
疾病进展(Progressive disease,PD):在PD标准中,血小板和血红蛋白下降应除外治疗毒性和自身免疫性等非CLL原因导致的血细胞减少,无法区分时应该进行骨髓穿刺或活检予以鉴别诊断。
微量残留病(Minimal residual disease,MRD):对于达到CR的患者,应该考虑进行MRD检测以进一步评价缓解深度,鼓励申请人在临床试验中探索MRD在预后判断和治疗方案优化(例如停药指导)方面的价值。流式细胞术、聚合酶链式反应(PCR)是较为成熟的MRD检测方法,也可以采用二代DNA测序技术(NGS),检测方法的敏感度应该足以检测到10,000个白细胞中的1个CLL细胞(MRD<10-4或0.01%)。MRD检测的取材可以是骨髓和外周血,但两种取材的检测结果存在差异,有研究表明骨髓中不可检出MRD(uMRD)相比外周血uMRD是更好的预后指标[8],但外周血取材更加便利且创伤性更小。建议根据临床试验中具体的试验药物、MRD检测的目的和患者人群的治疗目标,合理选择MRD检测的标本取材和检测时间点,并在研究方案中预先规定。在计算uMRD率时,应以所有接受治疗者而非达到CR者作为分析集。
(二)时间相关指标
无进展生存期(Progression-free survival,PFS):定义为从首次接受治疗之日(随机对照研究中为随机之日)至疾病进展的首个症状或体征变化出现之日或任何原因导致的死亡之日(以最早发生的事件为准)的时间。
无事件生存期(Event-free survival,EFS):定义为从首次接受治疗之日(随机对照研究中为随机之日)至疾病进展的首个症状或体征变化出现之日、或开始新的抗肿瘤治疗之日、或因为药物毒性退出试验之日或死亡之日(以最早发生的事件为准)的时间。以达到缓解为治疗目标时,可以结合前期研究的结果提出“治疗失败”的定义,即当治疗达到一定时长仍未实现治疗目标时,继续治疗获得有价值的临床获益可能性很小,则应该停止治疗。此时,“治疗失败”也构成EFS事件。
缓解持续时间(Duration of remission,DOR):定义为从确定缓解之日(完全缓解者为完成骨髓确认的时间)至疾病进展的首个症状或体征变化出现之日、或开始新的抗肿瘤治疗之日、或死亡之日(以最早发生的事件为准)的时间。在计算DOR时,如果最初评价为CRi或PR-L者的后续转为CR或PR,可以评价为CRi或PR-L的时间计算DOR;否则仅能在敏感性分析时计入CRR或ORR并计算DOCR或DOR。
总生存期(Overall survival,OS):定义为从首次接受治疗之日(随机对照研究中为随机之日)至死亡之日的时间。在CLL研究中,建议将死亡原因区分为CLL相关或非CLL相关,试验药治疗期间的非CLL相关死亡,应进一步分析是否与治疗毒性相关,对于高龄患者则需要考虑预期寿命对OS的影响。
创新机制-靶点药物应该在前期探索性研究中积极分析治疗后症状改善、缓解率、PFS和OS之间的相关性,作为关键性注册研究中替代终点的选择依据。对前期探索性研究中纳入的受试者进行长期持续的高质量随访,随访数据可以作为关键性注册研究的补充和支持。
(三)生活质量评价及患者报告结局
正如前文所述,考虑到CLL患者中相当一部分为高龄患者,需要在追求深度缓解和降低治疗毒性之间平衡取舍,保持或改善其治疗期间的生活质量(Quality of life,QOL)可能与延长其生存时间同等重要,并且有研究表明QOL对CLL患者的预后判断具有价值[1]。因此,在CLL患者中进行新药临床试验,应该常规进行QOL评估或使用患者报告结局量表获取患者的体验、见解或需求数据,甚至在决定剂量时考虑不同剂量对QOL的影响。QOL的评价可以采用成熟经验证的量表,例如EORTC QLQ-C30及其针对老年患者的增补QLQ-ELD14是临床试验常用的QOL量表;也可以参照相关指导原则[9]研发适合特定药物或人群的PRO测量量表。鼓励在临床试验中对生活质量校正的无症状或毒性生存时间(quality-adjusted time without symptoms of disease or toxicity,Q-TWIST)等质量和生存综合指标进行分析,作为治疗后获益和风险评价的支持性依据。
五、关键性注册研究
本章的内容主要针对关键性注册研究。探索性研究应该与关键性注册研究有良好的延续性,且其研究结果互为支持,因此在设计探索性研究时也可以参考本章提出的定义和要求。
(一)基线评估
初次诊断的患者应该在进入临床试验前,由中心实验室对部分关键诊断指标(例如外周血流式细胞术确定免疫分型)进行复查并进行诊断确认;其他患者人群涉及入排标准中关键要求的检查指标也应以中心实验室的检测结果作为筛查依据。进行全面的查体,尤其是浅表淋巴结、肝脾的触诊。评价体力状态、器官功能、合并症等以进行身体状态评估。进行全面的常规染色体核型分析,采用外周血进行荧光原位杂交技术(FISH)对del(13p)、+12、del(11q)、del(17p)等细胞遗传学异常进行检测,明确是否伴有TP53、IGHV、NOTCH1、SF3B1或BIRC3等基因突变。鼓励研发单位根据新药的靶点或作用机制预测获益患者的生物学特征并有选择地筛选受试者,或在试验中重点观察这些生物学特征对治疗反应的影响,必要时应探索新的生物标志物并分析其对确定新药治疗优势的价值。
完成并记录临床分期,包括Binet分期和Rai分期,采用慢性淋巴细胞白血病国际预后指数(CLL-IPI)进行危险分层。完成治疗指征评估。
(二)人群定义
既往未经过系统治疗的新诊断患者:临床实践中根据患者的年龄、有无del(17p)/TP53基因突变和身体状态来确定治疗方案,因此在目标人群的定义中需清晰地表述对上述情况的具体要求。若无del(17p)/TP53基因突变,区分为年龄<65周岁的年轻患者、年龄≥65周岁但身体状态良好的患者、年龄≥65周岁且身体状态欠佳三类。伴有del(17p)/TP53基因突变对化疗反应不佳。此外,可以根据前期研究中确定的优势人群对其他预后相关因素,例如IGHV基因突变状态、CLL-IPI危险分层等,提出相应的要求。
复发或难治患者:复发:患者达到CR或PR,缓解持续≥6个月后疾病进展;难治:治疗失败(未获PR),治疗期间或缓解持续<6个月疾病进展[3]。复发难治的患者将根据前期治疗方案、缓解持续时间、是否伴有del(17p)/TP53基因突变和身体状态确定后线治疗方案,因此在目标人群的定义时应该予以明确。对于难治患者,如果前期治疗方案为需要持续给药的小分子靶向药物,治疗失败者应该明确最短的治疗时长(可以根据药物治疗后中位达缓解时间提出要求)。治疗线数的确定:每种治疗方案应该有足够达到治疗目标的周期数;起始后线治疗前应该有明确记录的前线治疗失败、疾病复发或进展;如果接受某种治疗方案持续缓解≥2年且进展后重复该方案治疗,相同给药方案应该计为1线。
分层因素:患者的临床分期、CLL-IPI危险分层、del(17p)/TP53基因突变、IGHV基因突变状态、既往治疗线数、是否对某一类药物难治等均可能影响患者对其他药物/方案的治疗反应,建议根据具体药物和其他研究设计要素选择合理的分层因素。
(三)对照选择
原则上,应该选择目标人群现有最佳治疗手段作为关键性注册研究的对照治疗。按照“5.2人群定义”中所述,CLL患者的治疗决策考虑因素较多,对照方案的选择应与人群定义相匹配。一般而言,伴有del(17p)/TP53基因突变者对化疗反应不佳,现阶段可以选择BTK抑制剂±CD20单抗作为对照治疗;不伴有del(17p)/TP53基因突变者,年轻或身体状态良好者可以选择高强度的免疫化疗方案,而身体状态不佳的患者可以选择降低强度的免疫化疗方案或者去化疗靶向治疗方案作为对照治疗。对照治疗可以是单一的标准方案或推荐方案,也可以是可供研究者选择的多个方案。如果是在现有标准方案或推荐方案的基础上增加新药(add-on)或用新药替换已有药物,建议以增加或替换前的基础方案作为对照治疗。近年来,不断有新的CLL治疗方案出现,循证依据更新很快,临床实践中的治疗理念也在不断发展,因此建议在开展关键性注册研究前就对照治疗的选择与药审中心进行沟通交流。
境内外CLL适应症的药物可获得性存在差异,标准治疗方案和推荐治疗方案不尽相同,在开展国际多中心临床试验时应该关注协调,积极与药审中心进行沟通交流。
(四)研究终点
CLL的主要治疗目标包括症状改善、持久的疾病缓解和延长生存时间[2],在确定临床试验的主要终点时应结合目标人群的特征、药物的作用机制和安全性特征选择既符合治疗目标又能体现药物治疗优势的指标作为主要研究终点。无论直接的治疗目标是什么,都不应该以牺牲患者的生存时间为代价,并且应该在延长生存时间时兼顾患者生活质量的保持或改善。
CLL是一种惰性疾病,按照CLL-IPI的危险分层,即使高危人群5年生存率也达到63.6%[3],在以OS作为主要疗效终点不具有可操作性时,以替代终点PFS作为主要疗效终点支持常规批准是可以接受的[10]。在以PFS主要疗效终点的主要分析结果作为上市许可申请的关键性数据时,同期的OS数据应该显示出PFS获益与OS改善之间存在良好的相关性。在完成主要疗效终点的主要分析后,应继续对PFS、OS等时间相关指标进行长期随访,作为整体获益风险评价的依据。在对OS数据进行分析时,应考虑死亡原因尤其非CLL相关死亡对结果的影响,区分治疗毒性导致的死亡和患者衰老引起的死亡,必要时可采用年龄校正后的预期寿命等指标对死亡数据进行敏感性分析。应该提供独立疗效评价委员会盲态下评估的ORR、PFS结果,与研究者评估结果相互支持。
关键性注册研究须按照本技术指导原则“4.3生活质量评价及患者报告结局”中的要求,对患者的QOL进行评估,作为获益风险评价的一部分。无质量或低质量的生命延续是不具有临床价值的。
近年不断涌现新药物和新方案,CLL患者的PFS显著改善,即使以PFS作为主要疗效终点的临床研发周期也被明显延长,给新药研发带来了不小的挑战。鼓励研发机构从以下几个方向加强探索:1、优势人群挖掘。探索创新药在对现有治疗手段反应不佳者中是否有突出优势,例如IGHV未突变和CLL-IPI危险分层为极高危都是独立的预后因素,意味着更短的PFS和OS;探索可进行人群富集的生物标记物,打破常规的诊断局限,扩大目标适应症人群缩短研发周期。2、替代终点与临床终点的相关性研究。在探索研究阶段,积极发现可代表药物治疗优势的有效性指标,研究并验证该有效性指标成为与临床终点具有良好相关性的替代终点的可行性。3、突破传统治疗策略。对当前常规治疗策略无法满足的临床需求进行深入地剖析提出解决思路,并在新药临床研究中加以探索验证作为关键性注册研究的设计依据。
六、安全性评价
由于CLL患者多数因原发病影响存在血细胞降低,因此在治疗期间发生外周血细胞下降,需分析其原因是治疗相关的血液毒性还是疾病复发/进展,必要时应该进行骨髓穿刺或活检。临床试验中,在患者起始治疗前进行一次骨髓穿刺/活检,有助于对治疗期间原因不明的外周血细胞下降进行鉴别。
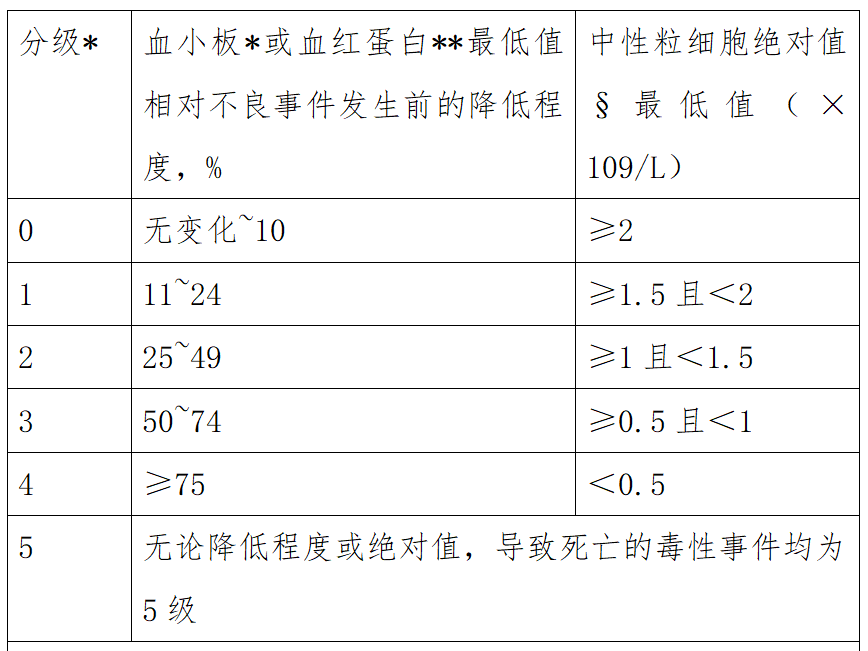
由于多数CLL患者在临床试验的基线期即存在一定程度的外周血细胞计数降低,因此采用与其他瘤种相同的血液系统毒性评价标准,可能会导致起始治疗时患者已经存在2-4级血液系统毒性。因此,针对CLL的特点,可以考虑采用表1所示的改良后血液系统毒性评级标准[1]。

非血液系统毒性的评级与其他瘤种采用相同的标准,通常在临床试验中使用NCI-CTCAE的最新版本。
七、上市后要求
应至少从以下三个方面考虑CLL创新药的上市后要求:
1、继续充实长期用药的安全有效性数据:上市前注册研究继续随访,上市后开展真实世界研究,广泛收集患者长期用药的安全有效性数据,并且在更具多样性的大样本人群中观察用药的安全性。
2、给药方案优化:很多给药方案相关的问题可能无法通过上市前注册研究得到解决,例如长期不间断给药的合理性和停药时机,应在上市后继续研究优化。考虑到个体风险和预后因素对CLL治疗方案选择的影响,鼓励申请人在药物上市后继续探索研究具有不同特征患者是否需要接受差异化治疗。
3、临床风险管理计划:针对老年患者的特点制定合理的患者关爱计划或教育材料,减少老年患者用药错误风险,或降低因长期与其他药物合并使用带来的风险。
1. BuskeC., Hutchings M., Ladetto M., et al. ESMO Consensus Conference on malignant lymphoma: general perspectives and recommendations for the clinical management of the elderly patient with malignant lymphoma. Annals of Oncology. 2018, 29(3): 544–562,
2. MukkamallaS.K.R., Taneja A., Malipeddi M., et al. Chronic Lymphocytic Leukemia[M]. StatPearls Publishing; 2022 Jan-.
3. 中华医学会血液学分会白血病淋巴瘤学组, 中国抗癌协会血液肿瘤专业委员会,中国慢性淋巴细胞白血病工作组.中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版)[J]. 中华血液学杂志, 2018,39(5) : 353-358.
4. Scotté F., Bossi P., Carola E., et al. Addressing the quality of life needs of older patients with cancer: a SIOG consensus paper and practical guide[J].Ann Oncol. 2018, 29(8):1718-1726.
5. Parmelee P.A., Thuras P.D., Katz I.R., Lawton M.P.. Validation of the Cumulative Illness Rating Scale in a geriatric residential population[J]. J Am Geriatr Soc. 1995, 43(2):130-137.
6. 国家药品监督管理局药品审评中心. 抗肿瘤药物临床试验终点技术指导原则[EB/OL]. (2012-05-15) [2022-05-06]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=24d174aa6995cf17e7aa12d6aa0317aa.
7. Hallek M., Cheson B.D., Daniel Catovsky D., et al.iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL[J].Blood. 2018, 131(25):2745-2760.
8. Wierda W.G., Rawstron A., Cymbalista F., et al.Measurable residual disease in chronic lymphocytic leukemia: expert review and consensus recommendations[J]. Leukemia. 2021, 35(11):3059-3072.
9. 国家药品监督管理局药品审评中心. 患者报告结局在药物临床研究中应用的指导原则(试行)[EB/OL]. (2021-12-27)[2022-05-06]. https://www.cde.org.cn/main/news/viewInfoCommon/c2f79c22e8678241b030c71523eb300c.
10. FDA. Table of Surrogate Endpoints That Were the Basis of Drug Approval or Licensure[EB/OL]. (2022-02-28)[2022-05-06]. https://www.fda.gov/drugs/development-resources/table-surrogate-endpoints-were-basis-drug-approval-or-licensure.
《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》
一、背景
单臂试验(single arm trial,SAT)是指设计为开放,不 设立平行对照组的一种临床试验。在抗肿瘤新药研发中,单 臂试验最初常用于传统的细胞毒类抗肿瘤新药早期探索性 阶段,通常采用最大耐受剂量(maximum tolerated dose,MTD) 作为试验药的剂量选择依据,利用单臂试验对研究人群和联 合给药方案的有效性进行早期探索,最终通过随机对照试验(randomized controlled trial,RCT)来确证和评价新药的获益风险比。
然而,对于绝大多数罹患晚期恶性肿瘤的患者,在缺乏有效治疗手段的情况下,生存期较短,可能没有时间等待需要大样本随机对照确证性临床试验结果数据支持上市的新药,急需尽早获得可能有效的新治疗机会。因此,在抗肿瘤治疗领域,为了推动新药及早上市,解决患者未满足的临床急需性,从上世纪九十年代初,一些国家的药品监管部门就开始采用依据 SAT 十分显著的有效性结果而予以附条件批准药物上市的监管决策模式。
SAT 的研发策略显著地缩短了新药的上市时间;特别是近年来,随着医学基础研究的深入和制药科学技术的发展,许多新药在临床研究早期阶段就显现出非常突出的有效性数据,因此,越来越多的研发企业希望采用 SAT 支持抗肿瘤药物的上市申请。
通过 SAT 支持抗肿瘤药物的加速批准,是以患者为核心,以临床价值为导向,适当权衡获益与风险的结果。与公认的金标准——RCT 结果相比,SAT 的结果用于新药获益与风险评估具有一定的不确定性。对于晚期恶性肿瘤患者而言, 虽然仍存在未满足的临床需求,但是越来越多创新药的上市, 使患者的生存期不断延长,部分瘤种已呈现慢病化特征;一些肿瘤治疗领域已逐步从“无药可治”向“有药可治”、“有药可选”的方向发展。在这种药物研发格局和临床实践变化的趋势下,对单臂临床试验不确定性风险的可接受程度也在逐步变化;因此,通过 SAT 支持批准药物上市时,必须严格其适用条件,确保其治疗获益大于 SAT 自身不确定性所带来的风险,并尽可能扩大获益风险比。
本指导原则旨在阐明当前对 SAT用于支持抗肿瘤药上市申请的适用性的科学认识,以期指导企业在完成早期研究 后,更好地评估是否适合开展 SAT 作为关键临床研究用以支持后续的上市申请。本指导原则中所讨论的“单臂临床试验”,均指支持药物上市申请的关键性单臂临床试验。
本指导原则适用于抗肿瘤治疗性药物,不涵盖细胞治疗和基因治疗产品。本指导原则仅代表药品监管部门当前的观点和认知;随着科学试验的进展,相关内容将不断完善与更新。应用本指导原则时,还请同时参考药物临床试验质量管理规范(good clinical practice,GCP)、人用药品技术要求国际协调理事会( International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)和其他国内外已发布的相关指导原则。
二、单臂临床试验的局限性
SAT不设立平行对照,而是采用外部对照,如历史对照, 即采用他人的或过去的研究结果,与试验组进行对照比较。由于历史对照数据来自不同时期的不同研究,在未设立平行对照的情况下,SAT在评价时会引入偏倚因素,这导致采用SAT 结果作为获益风险评估依据时,存在多种不确定性(包括但不限于):
疾病定义和诊断标准可能随着医疗实践的发展而发生变化,因此,SAT 与历史对照数据中患者人群可能存在差异。尤其是随着对疾病认知深入、诊断方法和诊断工具精准度的提升,即使采用相同诊断标准的患者,在疾病状态(包括肿瘤负荷、转移情况等)方面也可能存在不同。
SAT 与历史对照数据中,患者人群的入排标准可能不同;同时也无法对影响预后的因素进行分层均衡。就疾病本身而 言,不同地区、相同疾病患者的预后可能不同;随着医学发 展,抗肿瘤治疗及肿瘤支持治疗水平在不断提高,同一地区、相同疾病但处于不同时期的患者的预后也可能不同。
上述因素均可以造成 SAT 入组人群与历史对照人群的潜在差异。
在临床实践中,有效性评价方法可能发生变化,例如,淋巴瘤治疗的有效性评估方法就经历了 Cheson 1999,Cheson 2007 和 Lugano 2014 等多个评估标准的更迭。评估标准的变化可能影响单臂试验结果与历史数据间的可比性。此外,即使采用同样的方法,也可能存在由于不同评估者的主观差异而导致结果不可比。
在 SAT 中,通常采用客观缓解率(objective response rate, ORR) 作为替代终点评估有效性, 而很少采用总生存期(overall survival,OS)等反映生存获益的临床终点。
在部分瘤种中,ORR 的升高并不一定与生存获益直接相关或者密切相关;晚期肿瘤患者用药安全性也是影响生存获益的重要因素。例如,药物不良反应可能导致患者过早停止治疗,此时即使该药物的客观缓解率较高,患者也可能由于过早停药而导致肿瘤复发进展,因此不能达到延长生存的目的。
在恶性肿瘤性疾病中,OS 既是有效性指标,也是反映药物安全性的指标,因此是有效性与安全性叠加的结果。缓解率是肿瘤对于药物产生应答反应的表现,反映的是药物的药效学作用,因此高缓解率是否可以代表或转换为患者的生存获益,存在着不确定性。SAT 以 ORR 为主要终点,往往只能反映药物的药效学作用,难以反映最终的获益风险特征。
患者参与临床试验时通常受到更多的关注和医疗护理;作为一项开放研究,研究者对研究结果往往可能存在较高的期待。在非盲态、无平行对照的情况下,这些因素都可能影响 SAT 结果的可靠性。
获益风险评估是判断药物是否可以上市的关键因素。由于 SAT 的局限性,在通过 SAT 结果进行获益风险评估时, 可能存在不确定性,当计划以 SAT 作为关键研究支持抗肿瘤药物上市时,必须以患者为核心;只有充分权衡风险与获益,满足其治疗获益大于 SAT 自身不确定性所带来的风险时,方可接受 SAT 结果支持药物上市。
为了高效地通过 SAT 支持药物上市,减少其不确定性带来的不利影响,需要从 SAT 的适用性条件和后续确证性要求两个方面予以关注。
三、单臂临床试验设计的适用性
采用 SAT 支持药物上市的关键临床试验,一般适用于以下情况:
1、研究人群无有效的治疗选择
恶性肿瘤作为危及生命的一类疾病,其中大多数患者仍然无法治愈,因此始终存在未被满足的临床需求。为了能够给肿瘤患者提供获益风险特征确切的治疗,对于具有标准治疗的肿瘤,通常不适合采用 SAT,而应该开展 RCT。
对于无有效治疗选择的肿瘤(例如晚期难治复发肿瘤、或无标准治疗的肿瘤)患者,由于治疗需求极为急迫,此时可以考虑采用 SAT,使无药可治的晚期恶性肿瘤患者,更早地接受到潜在的有效治疗。
SAT 的人群定义,即入排标准是否符合“无有效治疗手段的肿瘤患者” 的基本要求, 应在递交临床试验申请(Investigational New Drug,IND),或在关键临床试验前(pre- IND)与监管机构进行沟通交流时,予以明确和细化[3]。在上市申请前(pre-NDA)沟通交流以及上市申请(New Drug Application,NDA)审评期间,监管机构还将逐例地梳理受试者既往治疗史,以确保受试者符合“无有效治疗手段的肿瘤患者”的身份。
2、试验药物作用机制明确
机制研究包括对于疾病致病机制和药物作用机制两个方面。当致病机制清晰,药物作用机制也清晰并且与致病原因相匹配时(例如,已知 A 肿瘤是罕见肿瘤,A’是导致 A 肿瘤发生发展的、明确的致病基因,并且有证据表明当 A’基因的转录表达受到抑制后,可对A 肿瘤产生治疗效果;所研发的B药明确具有抑制A’基因转录表达的作用),将增强药物疗效的可靠性,降低 SAT 结果的不确定性。
例如,抗肿瘤药物多是针对全身增殖细胞(如化疗), 或针对某种特定肿瘤的特定靶点进行治疗(如小分子靶向治疗药物)。但是,随着对疾病认识的不断提高,对肿瘤的认识逐步由组织细胞学向分子学层面发展;逐步出现以某个特定的肿瘤生物标志物,而非以肿瘤组织来源确定适应症的治疗药物(如针对“泛瘤种”(pan-tumor)的抗肿瘤药物)。如果导致肿瘤发生的驱动因素清晰,所开发的药物针对于肿瘤驱动因素,并且作用机制明确,此时可以考虑在不限定瘤种(以传统的组织细胞来源确定的瘤种)中开展 SAT。
3、适应症外部对照疗效数据清晰
在 SAT 中,虽然没有平行对照组,但其实质是与代表当前临床实践的外部数据进行的对照研究(如:历史对照、采用真实世界数据的平行对照等)。
采用历史对照的,在明确目标人群后,应确定目标人群 的历史对照数据。历史对照数据应来自高级别循证医学证据, 应具备相近年代、相似疾病背景和足够的样本量等特点。数 据可来自单个 RCT、系统回顾或 Meta 分析的结果,应提供分析并阐明历史数据的可靠性。历史对照数据也可以来自于 早先获得的真实世界数据,需考虑不同历史时期对疾病的定义、诊断、分类、自然史和可用的治疗手段等对可比性的影响。
此外,还可以采用真实世界证据进行外部对照,此时则是将与单臂试验同期开展的疾病登记数据作为对照。具体要求可参考《真实世界证据支持药物研发与审评的指导原则(试行)》。
4、试验药物有效性突出
通常,即使是无标准治疗的疾病,也可以与安慰剂/最佳支持治疗(best supportive care,BSC)进行对照研究,以证实药物的有效性;但是如果早期临床研究数据已经提示试验 药物存在非常突出的疗效,并且试验人群是晚期无有效治疗 选择的肿瘤患者时,则希望入组的受试者均能接受试验治疗, 得到潜在的抗肿瘤治疗机会;此时可不再要求采用安慰剂/BSC 对照,可以采用 SAT。
试验药物前期探索性研究数据应该提示临床疗效突出。一方面突出的疗效可以最大限度地确保药物的有效性—— 通常而言,对于已无治疗手段的肿瘤患者,在接受试验药物治疗后,疗效越好,来自于药物的可能性越高;另一方面, 是出于对获益风险的考虑——只有那些疗效突出的药物,其获益才更有可能大于 SAT 不确定性所带来的风险。
通常肿瘤治疗是以延长生存期为主要目标,对于某些肿瘤患者,即使没有达到客观缓解,但如果可以使肿瘤保持在稳定状态,也可能延长其生存期。在没有同期对照的情况下, SAT 的结果可能受到自然病程变化的干扰。对于肿瘤疾病而言,虽然一般不会发生自发缓解,但是肿瘤的“稳定”状态, 是因为治疗延缓了疾病进展,还是某些肿瘤自身惰性特征的体现,在没有平行对照的情况下,比较难以分辨,此时就很难全面评估药物治疗对患者生存时间的影响。
因此,在单臂试验中,有效性通常以 ORR 进行评价。某些瘤种也可能采用其他指标, 如完全缓解率( complete response rate,CRR),微小残留病(minimal residual disease, MRD)阴性比例等等。然而生存期的延长才是肿瘤患者最终的治疗目标,因此,对于疗效是否十分突出,不仅仅要评估缓解率,还应该提供持续缓解时间(duration of response, DOR)、无进展生存时间(progress free survival,PFS)等可能与生存获益相关的数据,以表明试验药物可以为患者带来有望转化为生存获益的治疗应答。
5、安全性风险可控
试验药物早期临床数据应提示其安全性风险可预期、可接受和可控制。早期安全性数据需要能基本表征试验药物的安全性特性。
由于单臂临床研究缺乏对照组,安全性数据解释具有局限性。如早期临床数据观察到以下(但不仅限于以下)情况, 建议谨慎考虑以 SAT 作为关键研究的合理性,避免对获益风险评估增加更多不确定性。
早期研究中发生高死亡率。ORR 即使达到预期终点,但由于高死亡率也未必能够转化成患者最终的生存获益;
因不良事件导致药物停药、剂量调整或中断的发生率较高, 或者药物引起的迟发性不良事件影响患者长期用药的耐 受性。例如:当早期临床数据已观察到一定比例的患者因 不良反应而进行剂量下调或终止治疗时,需考虑患者是否 会因上述治疗调整而导致疾病过早复发、进展;早期临床 数据所显示的高缓解率,是否会因患者的剂量下调和治疗 终止,而无法转化为患者的生存获益。
严重不良事件或者3-4 级不良事件的发生率明显高于预期或疾病本身/相似治疗人群的发生率。单臂试验由于缺乏对照,一些不良事件很难准确归因,很难明确判定是由于药物引起的还是疾病本身引起的,尤其是影响获益风险评估的不良事件(比如心血管事件、严重肝损害等)。
因此,当试验药物前期安全性数据提示其存在严重的或 重要的安全性风险时,应尽可能充分地进行分析和评估,其 安全性特征是否可以支持试验药物的后续开发;当前期探索 性临床试验中,有较多患者因不良反应进行药物减量、暂停 给药或终止治疗时,需评估不良反应对试验药物疗效的影响。
6、罕见肿瘤
对于罕见肿瘤有时很难开展 RCT 研究,此时可考虑采用 SAT 作为支持上市的关键研究。
本指导原则不对罕见肿瘤及其发病率进行具体定义。罕见肿瘤是一种动态变化的概念。某些肿瘤发病率虽高,但其中具有罕见突变、经治疗后难治复发的人群,则可能是罕见人群。另一方面,随着对肿瘤的认识逐步由组织细胞学向分子学层面发展,伴有特定突变的多个罕见瘤种,又可能共同组合成一组非罕见的、不限瘤种的“泛肿瘤”。
需要明确的是,患病人数少并不代表一定适用于 SAT;还需要结合疾病特点、发病机制、药物作用机制,以及药物对目标疾病可能产生治疗作用的多方面证据进行研判的基础上,综合决定是否可接受 SAT 支持药物上市申请。
上述列举的适用情况可能不能涵盖所有的情形。需要强调的是,上述单臂临床试验的适用条件,不是关键临床试验采用单臂研究设计的充分条件,即不是满足了上述条件就一定可接受 SAT 作为支持上市的关键性临床试验。最终是否可接受以 SAT 作为支持上市申请的关键研究,需综合试验药物在目标人群中潜在的获益风险比,以及疾病和药物的机制研究与 SAT 结果是否可以形成证据链,使 SAT 的结果足以预测/证实药物有效性等,共同判定采用 SAT 作为关键研究的合理性。
鼓励申请人与监管机构进行沟通交流,基于所开发的疾病、药物作用机制、拟开发药物的前期探索临床试验的数据等,共同讨论以 SAT 作为关键研究的合理性。
四、对确证性临床试验的要求
1、支持附条件上市申请
现阶段,当抗肿瘤药物采用 SAT 支持上市,根据《药品注册管理办法》[7]第六十三条,满足“治疗严重危及生命且尚无有效治疗手段的疾病的药品,药物临床试验已有数据证实疗效并能预测其临床价值”的前提时,该药物上市申请可适用附条件批准程序。
对于附条件批准的药品,上市许可持有人应当在药品上市后采取相应的风险管理措施,并在规定期限内按照要求完成确证性临床试验等相关研究。因此,申请人应及早开展确证性临床试验。当申请人计划以 SAT 作为关键研究时,即可以开始对后续的确证性研究进行规划,鼓励申请人及早与监管机构就确证性研究计划、试验设计进行沟通交流。
原则上,申请人应在附条件上市申请获批前,启动确证性临床试验。通常确证性临床试验包含以下两种类型:
RCT 是证明药物疗效的“金标准”,因此确证性临床试验一般情况下应该采用 RCT 设计,通常在与 SAT 研究相同(同一个治疗线)人群中,或者在 SAT 研究人群的前一个治疗线人群中开展。需关注的是,当决定在同一线人群中开展 RCT 作为确证性研究时,应尽早启动,因为当药物附条件获批上市后,对所批准的适应症人群而言,该药物已具备可及性, 此时在同一线人群中开展 RCT 可能存在困难。
对于确实因为不具备开展 RCT 的条件,而采用 SAT 作为关键研究的情况,也可考虑在相同人群中,再开展另一项SAT 作为确证性临床试验;或在同一 SAT 中继续扩展。作为确证性临床试验的 SAT,其样本量通常不能低于支持附条件上市申请的 SAT,且通常需要提供更长随访时间的有效性数据,以表明患者的生存获益。
2、支持常规批准
在极少数开展 RCT 存在难度的情况下(如开发罕见肿瘤适应症),在药物的疗效可以通过 SAT 得到确证的情况下, 也可能仅通过一项 SAT,支持药物的常规批准。
在缺乏对照的情况下,SAT 的结果很难独立确证药物的有效性,因此需要通过疾病致病/发病机制、药物作用机制(可能需要在其他疾病/瘤种中证实药物作用机制)、SAT 结果, 综合形成证据链,共同确证药物的疗效。
五、其他关注的问题
1、探索最优给药策略
对药物在目标人群中获益风险特征的评价,是评估药物 能否上市的基础。在获益风险评估中,涉及对有效性、安全 性的综合评价,而两者又与药物给药方案的合理性息息相关。
因此,药物的临床研发过程,也是在多方因素相互影响的关系中,寻找获益风险比最大化的过程。
早期探索研究是开展关键临床试验的基础。在早期探索不清晰、不深入或者扩展队列研究不充分的情况下,过早地开展关键单臂研究,将加剧 SAT 的不确定性,增加确证性研究的失败风险。
以细胞毒性药物为代表的传统化疗时代,通常是以 MTD 指导确定药物推荐剂量。随着靶向治疗、免疫治疗等新型治 疗药物的出现,抗肿瘤药物的剂量探索策略发生了巨大变化。以靶向治疗为例,常以靶点占有率作为重要的药效动力学( pharmacodynamics , PD ) 指标 , 结 合 药 代 动 力 学(pharmacokinetics,PK)特征,指导确定最佳给药策略。在靶点饱和后,更高的剂量可能不会使疗效进一步提高,但可能带来更多的安全性风险;更高剂量带来的安全性风险,可能会抵消甚至超过高剂量带来的疗效获益增加。
在开展 SAT 前,鼓励申请人对非临床和早期临床研究中的 PK、PD 或暴露-效应(exposure-response)等数据进行充分地分析,并建议以此为基础,在已知的安全剂量范围内, 选择至少 2 个候选给药方案,开展一定样本量的对照研究;在开展关键 SAT 前,确定合理的给药策略。
2、关注缓解质量
SAT 通常采用发生客观缓解的患者比例(如 ORR)为主要终点;为保证数据的完整性,原则上不接受单臂临床试验期中分析结果提交上市申请。SAT 中的缓解率,体现的是患者接受治疗后产生应答的概率;患者接受治疗后,是否会获得生存期的延长,在缺乏平行对照的 SAT 中,很难直接判断。因此,在对缓解率进行评估时,还需要关注缓解的“质量”, 即产生应答的患者是否有望转化为生存获益。
例如,在以 ORR 为主要终点的研究中,关注其中发生完全缓解(complete response,CR)的比例,或者 MRD 阴性患者的比例。通常而言,缓解深度越深,代表患者残留的肿瘤负荷越少,生存期延长的可能性越高。
单臂研究中,须关注 DOR,同时 PFS/PFS 率、OS/OS 率也是重要的支持数据。
随着药物研发进展,新机制、新结构的创新性治疗药物不断涌现,可能在研发过程中,出现一些既往未被发现或认识的问题。例如,某些免疫治疗药物,在治疗某种特定肿瘤时,可能发生超进展现象(hyperprogressive disease,HPD), 即免疫治疗可能促进了肿瘤进展,此时即便在用药早期患者发生缓解,这种缓解也很难为患者带来后续的生存获益。
在计划以 SAT 支持药物上市申请时,所获得的单药安全性数据应该能表征其基本的安全性特征,应能反映常见的不良反应,并且提示其安全性风险可以被接受和有效控制。
当在 SAT 中已观察到一定比例的患者因不良反应而进行剂量下调或终止治疗时,需考虑患者是否会因上述治疗调整而导致疾病过早复发、进展;SAT 所显示的高缓解率,是否会因患者的剂量下调和治疗终止,而无法转化为患者的生存获益。
此外,联合用药是抗肿瘤药物的研发趋势。以 SAT 支持附条件批准末线治疗适应症后,在前一线采用与标准治疗联合的方式开展确证性研究,是较为常见的研发策略。当单药已存在较为明显的安全性风险时,需要考虑患者是否可耐受联合用药,并且对联合用药的安全性是否会影响确证性对照研究的有效性结果进行预判。
4、对联合用药的考量
由于在无平行对照的情况下,很难通过 SAT 反映联合治疗各个单药对疗效和风险的分别影响,因此,原则上,联合治疗的关键研究不接受单臂试验设计。
如果联合用药的有效性非常突出,且申请人可以提供充分、可靠的析因分析时,申请人也可以与监管机构沟通联合用药采用 SAT 支持上市的可行性。
5、关注 IRC 的应用
当主要研究终点基于肿瘤测量评估(如 ORR)时,通常应由独立评审委员会 (Independent Review Committee,IRC) 进行评估,以确定不存在评估偏倚。
IRC 可以最大程度地减少在影像学评估和独立裁决过程中出现的偏倚。在开始研究之前,可参考 《抗肿瘤药临床试验影像评估程序标准技术指导原则》,制定清晰的章程计划, 概述 IRC 的职能和流程(独立评审章程)。
6、关注伴随诊断
在临床试验中,可利用生物标志物筛选富集预后更差、治疗难度更大的人群。由于单臂临床试验可适用于具有临床急需性的难治人群,因此单臂临床试验中,也可能需要采用富集人群策略,即以特定生物标志物识别预后更差的难治人群。当需要采用特定方法进行患者筛选/诊断时,建议及早考虑伴随诊断的同步开发。
六、总结
在抗肿瘤药物的开发中,有效性往往更受关注,但是支持药物最终上市的,不仅仅是有效性,而是对药物的获益风险评估。
SAT 设计实施简单易行,研究周期短、费用低,可以较快地获得有效性的证据,但是其研究结果在反映肿瘤患者生存获益时,存在一定的不确定性;因此对于以 SAT 支持上市的抗肿瘤药物,获益风险评估中包括对有效性、安全性以及SAT 结果不确定性的综合考量。通过 SAT 支持批准药物上市时,必须要确保药物治疗获益大于 SAT 自身不确定性所带来的风险。
在药物研发过程中,申请人应严格把握 SAT 的适用条件,并且科学地开展、实施 SAT;而上市后,应该按照要求及早开展确证性研究,以确保患者获益。
[1]. Downing NS, Aminawung JA, Shah ND, et al. Regulatory review of novel therapeutics--comparison of three regulatory agencies. N Engl J Med, 2012,366(24):2284-2293.
[2]. Carpenter D, Zucker EJ, Avorn J. Drug-review deadlines and safety problems. N Engl J Med, 2008,358(13):1354-1361. [3]. 国家药监局药审中心关于发布《单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则》的 通 告 (2020 年 第 47 号 ) https://www.cde.org.cn/main/news/viewInfoCommon/2a6d7894c 0ee2aaa37fd1ca8e941cdab.
[4]. 国家药监局药审中心关于发布《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则》的通告(2020 年第 46 号)https://www.cde.org.cn/main/news/viewInfoCommon/e303bd3de b01db072c7b37cd46195a67.
[5]. 《真实世界证据支持药物研发与审评的指导原则(试行 ) 》 . https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=d b4376287cb678882a3f6c8906069582.
[6]. 国家药监局药审中心关于发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的通告(2021 年第 46 号)https://www.cde.org.cn/main/news/viewInfoCommon/ef7bfde96c 769308ad080bb7ab2f538e.
[7]. 药 品 注 册 管 理 办 法(2020 年 1 月 22 日国家市场 监 督 管 理 总 局 令 第 27 号 公 布 ) http://www.gov.cn/gongbao/content/2020/content_5512563.htm.
[8]. 国家药监局药审中心关于发布《抗肿瘤药联合治疗临床试验技术指导原则》的通告(2020 年第 55 号). https://www.cde.org.cn/main/news/viewInfoCommon/e48621041 8ae46e01cebe7f05067f86c.
[9]. 国家药监局药审中心关于发布《抗肿瘤药临床试验影像评估程序标准技术指导原则》的通告(2021 年第 1 号). https://www.cde.org.cn/main/news/viewInfoCommon/4e20187d0e62e5c0c610e571a81d4d60.
资料来源:国家药品监督管理局药品审评中心官网
国家药品监督管理局药品审评中心官网:https://www.cde.org.cn/













